Molecular Medicine 2002年11月号に「グレリンの発見まで」という、論文発表の裏話を中心にエッセイを書いた。以下はその原稿である。(この「論文発表の舞台裏」シリーズは毎号楽しみにしていたのに、いつの間にかなくなってしまった。あまり面白くなかったのかな?)
論文発表の舞台裏
「グレリンの発見まで」
児島 将康
久留米大学 分子生命科学研究所
遺伝情報研究部門
1999年10月11日、振り替え休日の早朝、研究所にはNatureからacceptのFaxが来ていた。喜びよりも、われわれのグレリンを世に送り出せることが決まって、ホッとした気持ちの方が強かった。われわれの発見した成長ホルモン分泌促進ペプチド“グレリン”の論文は、Natureでのレフェリーの評価は高く、比較的簡単に受理された方かもしれない。しかしどのような論文でも世に出るまでの過程では、論文の内容からではわからない苦労があるものだ。
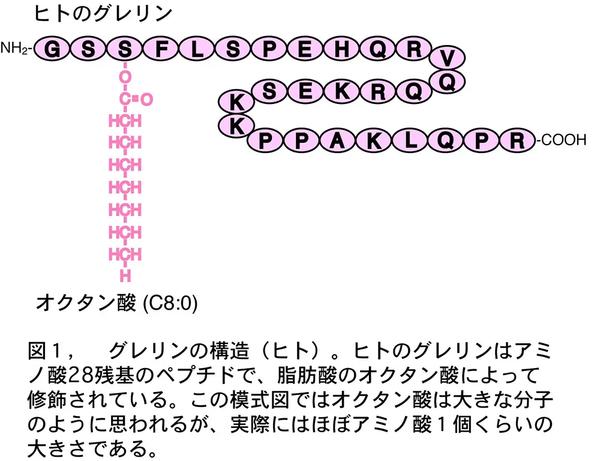
グレリンはリガンド不明なオーファン受容体の一つ、GHS受容体の内因性リガンドとして、われわれが胃から発見したペプチド・ホルモンである(1,2)。グレリンは3番目のアミノ酸残基、セリンの側鎖が脂肪酸のひとつオクタン酸で修飾されており、しかもこの修飾基が活性発現に必要であるという、これまでに知られていない構造をしていた(図1)。
グレリンは強力な成長ホルモン分泌促進活性と摂食亢進作用を示す、内分泌・エネルギー代謝を調節するペプチド・ホルモンである(3-5)。胃から成長ホルモン分泌を促進するホルモンが分泌されること、また活性発現に必須なオクタン酸による修飾構造などが、研究の重要なポイントだった。
1998年の初め頃から、われわれはいくつかのオーファン受容体の内因性リガンド探しを行っていたが、どれ一つとしてうまくいっていなかった。GHS受容体はその中でも、GHS(growth hormone secretagogue)と呼ばれていた一群の人工的な合成リガンドあるため、アッセイ系を常にモニターでき、安心して探索を続けられたが、内因性リガンドは長い間見つかっていなかった(6)。 GHS受容体は、視床下部、下垂体に発現していることから、われわれは、そしておそらく世界中の他の研究グループも、脳から内因性リガンドの探索を行っていた。われわれは脳からの探索の過程でいくつかの活性ペプチド断片を精製したが、これらはいずれも蛋白質の切れ端で(例えばプルキンエ細胞蛋白質2、ミエリン・ベーシック蛋白など)、比活性も弱く、真のリガンドではなかった。
1999年1月、オーファンGHS受容体のアッセイを開始して、早くも1年近くになろうとしていたが、まったく先の展望が見えなかった。私と大学院生の細田君(現・京都大学探索医療センター助手)はくる日もくる日も、クロマトグラフィーとアッセイを続け、すでに500回を越えるアッセイを行っていたが、全く何の手がかりも得られていなかった。脳以外の組織も調べて見ようかと思い始めていたが、脳をあきらめるのにはものすごく勇気がいった。おそらく他の研究グループも同じ考えだったろうが、GHS受容体の分布からは、内因性リガンドの存在部位として脳がもっとも可能性の高い組織だったからだ。
当時GHS受容体にホモロジーが高い、やはりオーファン受容体にGPR38が知られていた(7)。 GPR38はその後モチリン受容体と同定されたのだが、その時にはやはりGHS受容体と同じく内因性リガンドは不明だった(8)。手詰まりの状況のなかで、私はGHS受容体とGPR38はファミリーなのだから、それぞれのリガンドは他方の受容体にクロス反応するだろうと考えた。GPR38のリガンド構造がわかれば、GHS受容体のリガンド構造にも何かヒントが得られるだろう。運がよければ遺伝子あるいはESTデータベースのホモロジー検索から、GHS受容体リガンドの構造もわかるかもしれない。 GPR38は胃および甲状腺に多く発現していた。そこで胃の抽出物をGHS受容体発現細胞株でアッセイすることにした。図2は1999年2月9日、胃ペプチド抽出物のゲル濾過カラム・サンプルの1回目のアッセイ結果である。
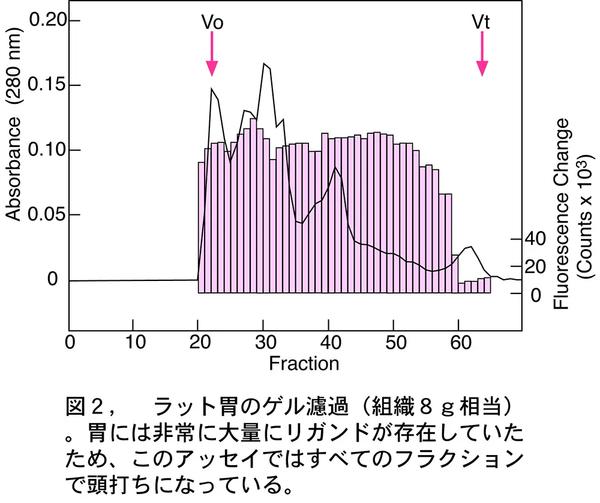
全フラクションで強い細胞内カルシウムの上昇がみられたため、これは何か変 なことが起こっているに違いないと考えた。ちょうどその1週間前に、別のオーファン受容体発現細胞で、細胞が壊れて、全フラクションで細胞内カルシウム上昇がみられるという経験をしていたのだ。 胃には何か細胞を壊すような活性を持ったペプチドでも存在するのかなと考え、胃はひとまず置いておいて、別の組織のアッセイに取りかかった。それでも活性らしきものは見つけることができず、毎日、アッセイ結果の検討と過去のアッセイ・データとのにらめっこだった。
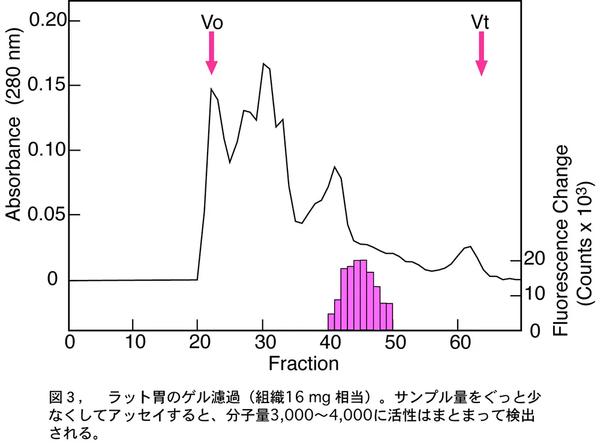
3週間くらいして、もしかしたらと思い直し、再び胃のアッセイを、今度はサンプル量を以前の1/10で行った。結果は同じで全フラクションで強い細胞内カルシウム上昇がみられた。やはり、胃には何か変な、細胞を壊すような物質があるに違いないと、再びそのまま放っておいた。さらに行き詰まった1ヶ月後の3月中旬、データを見直していたとき、もしかしたら胃にはGHS受容体のリガンドがすごく多量に存在するのではと気づき、今度はサンプル量をぐっと少なくしてアッセイした。すると活性は分子量約3,000~ 4,000くらいのところに、きれいにまとまるではないか(図3)。つまりゲル濾過のピーク解像度はそれほど高くないため、前回のアッセイでは全フラクションで頭打ちになるほど多量の内因性リガンドを使ってアッセイをしていたのだ。わずか数mgの組織抽出物からでも、活性が測定できるほど、ものすごく多量のリガンドが胃に存在していたのである。胃から成長ホルモン分泌促進ペプチドが分泌される! リガンドは微量にしか存在しないだろうとか、成長ホルモン分泌は脳によって制御されているという先入観によって、すぐに気づかなかった自分が情けなかった。
われわれは喜び勇んで精製を進めた。わずか数グラムのラット胃組織抽出物から、ほんの10日ほどで精製は完了した。3月30日だった。リガンドはあまりに多量に存在していたため、これでは他のグループも簡単に精製できるに違いない、もしかしたらもう論文を投稿しているかもしれない。それからは毎週木曜日のNature、金曜日のScience、隔週金曜日のCellなどの発行日は、毎朝自宅でこれらのホームページをチェックするのが怖かった。先に発表されれば、その時点でわれわれの苦労も水の泡だからだ。
それからわれわれは、今まで以上に実験をした。シークエンサーでアミノ酸配列を解析すると、3番目のアミノ酸が同定できない。同時に行っていたcDNAの解析からは、3番目のアミノ酸はセリン残基だった。なぜ、セリン残基が同定できないのだろうか? 疑問に思いながらも、ともかく3番目をセリンとしてペプチド合成した。その間にラット、ヒトのcDNA構造解析を1週間ほどで終え、ノーザンブロットで胃がメインの発現部位だと確認した。そして合成したペプチドの活性を調べた。活性が全くない? 何度やっても同じだった。しかもHPLCで、合成したペプチドと精製したペプチドの溶出時間がすごく違う。精製したピークに含まれるマイナー成分が真の活性なのだろうか? いや、活性に必要な量から推測すると、精製したペプチド以上に強い活性のマイナー成分はありそうになかった。つまり、3番目のセリン残基が何かで修飾を受けており、これが活性発現に必要なのだろう。
この修飾基の構造はいったい何なのだろう? マス・スペクトルによる分子量測定では、精製したリガンドは合成したペプチドより、分子量126だけ大きかった。つまり分子量126の分子がセリン残基を修飾しており、この修飾基が活性発現に必須なのだ。これまで知られているペプチドの修飾基構造、たとえばリン酸基やCCKのスルフォニル基では分子量が合わない。アミノ酸、糖質、金属などにも分子量が一致する物はなかった。cDNA構造、ノーザンブロット解析もすでに終えており、修飾基とは関係のないC末端部分を使って、抗体もすでに作製を始めていた。しかし肝心の活性構造がわからず、活性のあるペプチドを合成できない状況では生理実験はできなかった。これまでの合成GHS研究の蓄積から、このリガンドの成長ホルモン分泌促進活性は明らかであるにもかかわらずだ。
私、細田君と寒川部長の3人は、土曜日も日曜祝日も研究室に出てきては、昨夜の間に何かアイデアが浮かんだか話しあったが、糸口はつかめなかった。その時にできる実験はすべて終えており、3人とも何をするともなしに研究室をうろうろしていた。こんなに大量に存在するペプチドなのだから他のグループも精製に成功しているに違いない。修飾基の構造も解明して、一番乗りの祝杯をあげているかもしれない。われわれはこの修飾基の構造がわからなければ発表もできないし、かといって時間が経てば構造がわかるという保証など全くなかった。このまま構造は永久にわからないままなのではと、不安にかられる毎日だった。
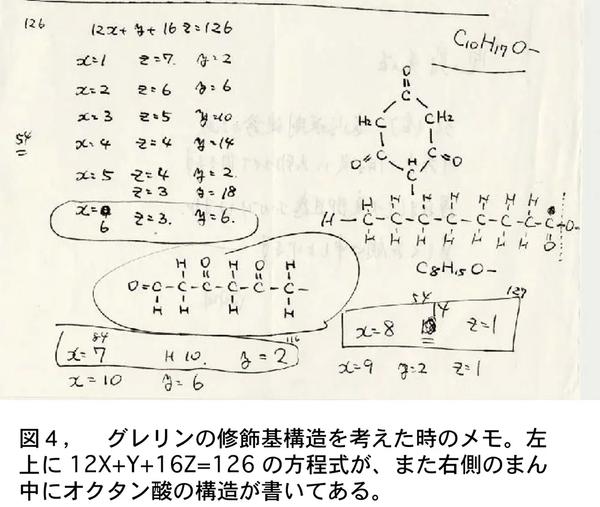
精製完了からすでに1ヶ月以上経過しても、修飾基の構造は依然としてわからなかった。5月のゴールデンウィークになっていた。実家に帰る用があり、電車のなかでぼんやりと修飾基の構造について考えていた。分子量126が頭から離れなかった。126,126---。ある瞬間にひらめいた。もしこの修飾基が有機化合物なら、簡単な数式で解けるのではないか、と。 12X+Y+16Z=126。Xは炭素数、Yは水素数、乙は酸素数、合計が分子量126。この方程式は高校程度の簡単な式で、X, Y, Zの場合の数を考えればすぐに解ける。しかも解は何通りかに限られるから、化合物の構造もある程度しぼれるのではないか。手帳に書いて計算してみると、うまくいきそうだ。さっそく翌日、研究室へ行って寒川部長に、こうやれば解けるのではと、昨日電車の中で思いついた計算式を説明した。方程式のいくつかの解から、考えられる化合物を書き出し検討した(図4)。私は「6角環の化合物が美しいから、これじゃないか」と言うと、「こんな構造があるわけがない、むしろこの脂肪酸が実験結果と合うのではないか」と、さすがに専門の有機化学の知識が豊富である。
この脂肪酸のオクタン酸なら生体内でも合成されるだろうし、精製した天然のペプチドがHPLC上で溶出時間が遅い、つまり疎水性が強いことも説明できる。これだ、これしかない、とさっそくペプチド合成を近くのペプチド研究所に依頼することになった。脂肪酸で修飾されたペプチドの合成はわれわれには手に負えなかったのだが、さすがに向こうはペプチド合成のプロ。何の問題もなく、合成できると断言してくれた。それでもこのような、これまでに全く報告もない、奇妙な構造のペプチドをよく合成してくれたものだ。もっとも、 「紙の上での推測だけで、こんな奇妙な構造のペプチドをよく合成依頼したものだ」と、構造解明に成功してから松尾先生(当時・循環器病センター名誉研究所長、現・宮崎医科大学学長)にあきれられたことを覚えている。
6月初旬に合成ができたとの連絡がペプチド研究所からあった。暑い日だった。自転車で合成サンプルを取りに行った。帰りの道沿いの川に亀が泳いでいた。吉兆だと思った。研究所に帰り、さっそく天然精製物と合成ペプチドを混合して、HPLCで溶出をチェックした。クロマトグラフィーのチャートをじっと見ている間、不思議と不安感はなかった。この構造しかないと確信していたからだ。記録計のペン先が動き出す。ピークの出始めだ。やった、完全にピークが一致した。この構造で間違いない!翌日にはGHS受容体発現細胞で活性をチェックした。活性はみごとに天然物と一致した、完璧に。物理化学的な検討でも精製ペプチドと合成ペプチドとは完全に一致した。脂肪酸で修飾された生理活性ペプチド、しかも、この修飾構造が活性発現に必要なのだ(図1)。これまで誰も知らない謎を解 き明かしたことで幸せいっぱいだった。
合成ペプチドを使った生理実験もすぐに始めた。平行して論文も書き始めた。おもしろいように文章が湧いて出て書くのが楽しかった。一ヶ月くらいで生理実験を順調に終え、論文もほぼできあがった。投稿先はNatureをねらった。発見したペプチドの名前だが、研究社の英和辞典で調べて、"grow"の語源がインド・ヨーロッパ基語で"ghre" とのことから、これに生理活性ペプチドの命名によく使われる接尾語の"lin"をつけて、"ghrelin"と名付けた。これには "gh"、すなわちgrowth hormone (成長ホルモン)を "release"する意味も含まれ、いい名前だと自負した。もっともこのような名前がはたして欧米人に通じるか、知り合いの米国人の先生にたずねたところ、問題ないとの返事だったので安心した。ただし日本人泣かせの発音ではあるが。
かくて論文発表までの準備は整った。投稿直前の7月中旬には、軽井沢で小さな研究会があった。空いた時間には部屋で論文の最後の手直しをしていた。研究会の発表では、GHS受容体にクロス反応するプルキンエ細胞蛋白質2のペプチド断片の話をし、グレリンのことはいっさい話をしなかった。皆をだましたみたいで、申し訳なく思っている。研究会から帰って、論文の最終的なチェックをしてNatureに投稿した。最初の投稿時の著者は私、細田君、松尾先生、寒川部長の国立循環器病センター の4名だった。投稿してから久しぶりの休みを取った。もし投稿論文がレフェリーまでまわされないで、エディターの段階で却下なら1週間くらいで返事が来るだろうが、それはないだろうという自信があった。
8月もすぎ、9月1日にNatureからの返事が来た。なんと4名ものレフェリーからのコメントがあったが、いずれも非常に好意的でNatureに掲載すべきだとコメントしてあった。飛び上がるようにうれしかった。ただ図や文章など細かな変更点を求められたのと、レフェリーへの返事に視床下部でのグレリンの存在を示唆したところ、次のreviseではそのデータを要求された。どうも最近ではNatureの紙面がカラフルになったためか、写真やカラー図版が要求されることが多いようだ。われわれはすでにグレリン抗体を作製しており、その時点で別の論文のために宮崎医大の中里先生グループに免疫染色を依頼していた。グレリンの組織分布は別の論文にまとめようと予定していたため、組織の写真は次の論文で発表するから載せられないと返答した。
9月20日に返ってきたエディターからのコメントは、免疫染色の結果は論文受理に絶対必要だとの強い口調だった。おまけにレフェリーが一人増え、合計5人になった。5人目のレフェリーへの返答にグレリンとGHRHの作用の比較図を加えた。免疫染色に関しては、中里先生に無理をいって今回の論文に加えさせてもらった。10月2日、これで最後のreviseになるようにと、祈りながら投稿した。そして10月11日にacceptのFaxをもらったのだ。
グレリンの研究が評価されて、現在私は久留米大学にいる。あの時、もしそのまま脳に執着して胃のアッセイをやっていなかったら、あるいは修飾基の構造が解明できていなかったとしたら、今頃はどうしていただろうとよく考える。よい研究にはいくらかの幸運も必要だろうが、その幸運を得られるかどうかは、やはり研究に対する情熱だと思う。グレリンの探索において、われわれは他のグループよりもはるかに多くのアッセイをやり、数えきれないほどの失敗を重ね、それでも決してあきらめなかった。もしまだグレリンが見つかっていないのなら、われわれは今日もまたアッセイを行っているだろう。
- <参考文献>
-
- Kojima M, Hosoda H et al. Nature 402, 656 (1999).
- Kojima M, Hosoda H et al. Trends Endocrinol Metab 12, 118 (2001).
- Takaya K, Ariyasu H et al. J Clin Endocrinol Metab 85,4908 (2000).
- Tschop M, Smiley DL et al. Nature 407,908 (2000).
- Nakazato M, Murakami N et al. Nature 409, 194 (2001).
- Smith RG, Palyha OC et al. Horm Res 51(Suppl 3), 1 (1999).
- McKee KK, Tan CP et al. Genomics 46, 426 (1997).
- Feighner SD, Tan CP et al. Science 284, 2184 (1999).







